

在当今生物制药领域,AI技术凭借其卓越优势和无限潜力,正掀起一场革命性的变革浪潮。作为结构生物学领域的全球领跑者,维亚生物将AI技术与湿实验平台完美结合,为药物研发开辟了前所未有的崭新视野。AI在这一领域的应用无所不在,它不仅能精准预测药物与靶点的结合模式,还能助力科学家高效筛选出具有广阔前景的化合物,为后续优化工作指明方向。以最前沿的生成式AI为出发点,de novo design的方法还可以从头设计小分子、抗体等生物药,突破原有的药物设计框架。
目前,维亚已建成自有的小分子药物发现AIDD全流程技术平台,提供完整的AI驱动的药物发现解决方案,并大幅降低新药研发成本和周期,助力药物研发转型升级。例如使用主动学习的虚拟筛选,可将筛选的命中率从平均1%提高到20%以上,对应富集因子为20倍或更高,与维亚多个筛选平台联动、完成筛选并验证的速度达到以周为记,对应筛选费用降低为三分之一。采用自由能微扰技术和ADMET性质预测对设计的化合物做先行评估,可减少超过半数的化合物合成数量,从而降低实验人员投入,并将苗头化合物发现周期从12-36月缩短到6-18月。
干湿实验技术融合开辟了无限的应用可能性。维亚生物通过计算化学和人工智能方法,推动了靶向RNA小分子、多肽/环肽、抗体药物等新兴药物类型的发展,以及这些药物从头设计的方法发展。
小分子设计:
自由能微扰(FEP)非共价共价双管齐下
自由能微扰是业界公认的高精度结合能计算工具,在小分子的先导化合物优化过程中被广泛应用。在有充分的结合模式信息情况下,自由能微扰的误差可以达到1kcal/mol以内,可加快药物化学分子设计,提高成功率。维亚计算化学及人工智能平台在自有的FEP算法基础上,引入了量子力学,能准确捕捉共价反应的过渡态并计算其对应能垒,从而精确描述共价反应过程,并通过实验验证,得到了自由能变化与Kinact/Ki的高相关性。这一方法不受限于分子的共价弹头类型和共价反应类型,具有普适性,可以大大帮助共价化合物的设计并提高化合物对不同靶点的选择性。同时,自由能微扰(FEP)计算模块也是小分子药物AIDD发现中的重要组成部分。它与基于分子动力学的靶点结合位点发现与鉴定、AI赋能的大规模虚拟筛选、ADMET成药性预测等有效整合,构筑起一个的完整AI驱动的药物发现生态系统。
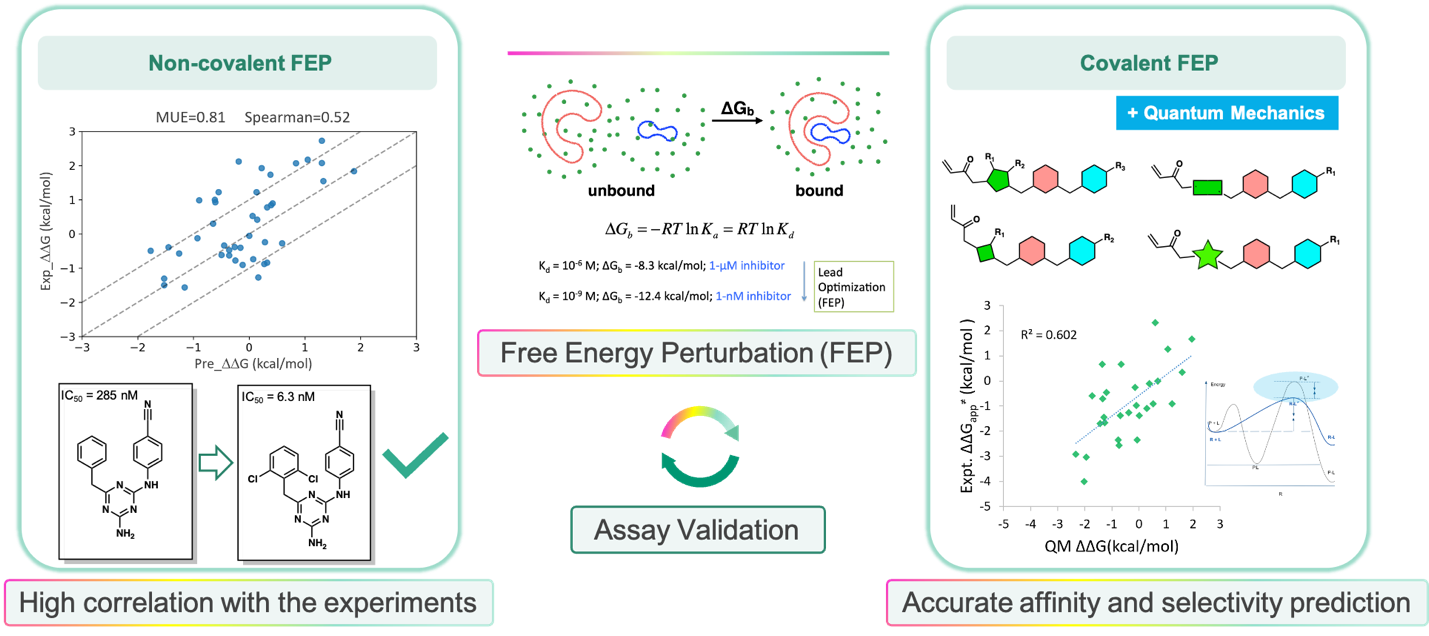
自由能微扰(FEP)用于非共价和共价亲和力预测
靶向RNA小分子设计:
维亚独有的AI + SBDD彰显优势
RNA作为靶点相较于传统的蛋白质靶点有其特殊优势,其靶点数量更多且可使原本不可成药的蛋白质靶标成药。随着2020年首个FDA批准的靶向RNA小分子Risdiplam成功上市,这类药物分子引起了业界的广泛关注,各家MNC竞相布局、相关Biotech公司也纷纷入场。从基于表型筛选的“偶然发现”到基于结构的理性设计,靶向RNA的小分子研究难点在于对作用机理的深入探究和基于结构的模型搭建。传统的方法在处理RNA结构时通常无法有效捕捉体系动态特征,也无法预测柔性大、电荷高的RNA在不同状态下的结构变化。维亚生物计算化学及人工智能平台有针对性地开发出基于分子动力学的研究方法,着力于描述体系的动态变化特征,特别是在小分子存在情况下RNA结合口袋的结构变化,总结出一整套参数指标,为靶向RNA小分子的设计铺平了道路,为理性药物设计提供了结构和量化指标的多维度参考。
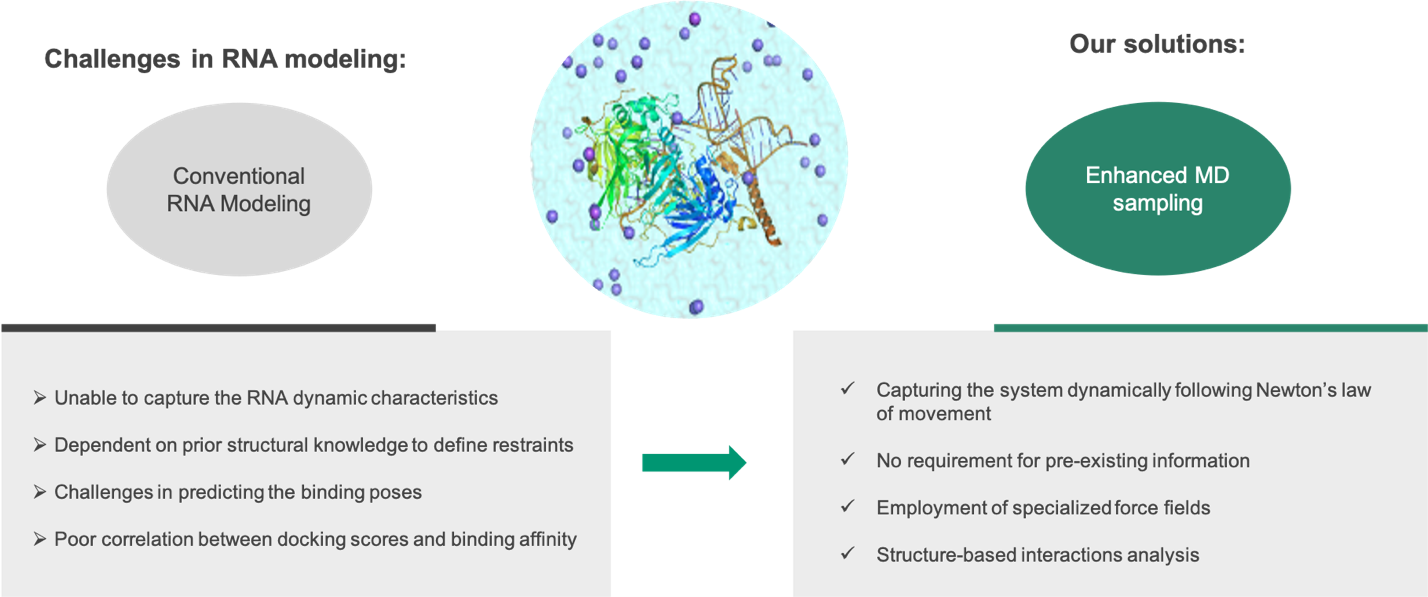
维亚独特的计算技术可攻克靶向RNA小分子难题
环肽化合物设计:
维亚AI + DEL的强强联合
环肽化合物在药物发现中适用于靶向蛋白-蛋白结合位点,相对于多肽有稳定性强、生物利用度高和特异性强等特点。但传统的筛选方法难以覆盖其对应的超大化学空间,普通的建库方法可能会导致极低的命中率,影响筛选效率。在维亚,我们采用AI和V-DEL筛选结合的方式,首先通过计算模拟富集多肽砌块,同时把关其理化性质,通过DEL构造完成超过十亿数量级的特定靶向多肽库,筛选完成后通过AIDD和CADD算法进一步优化命中的环肽化合物,并且在苗头化合物到先导化合物的过程中密切跟踪环肽的稳定性、透膜性等指标,最终找到结合力强、特异性高的环肽分子。
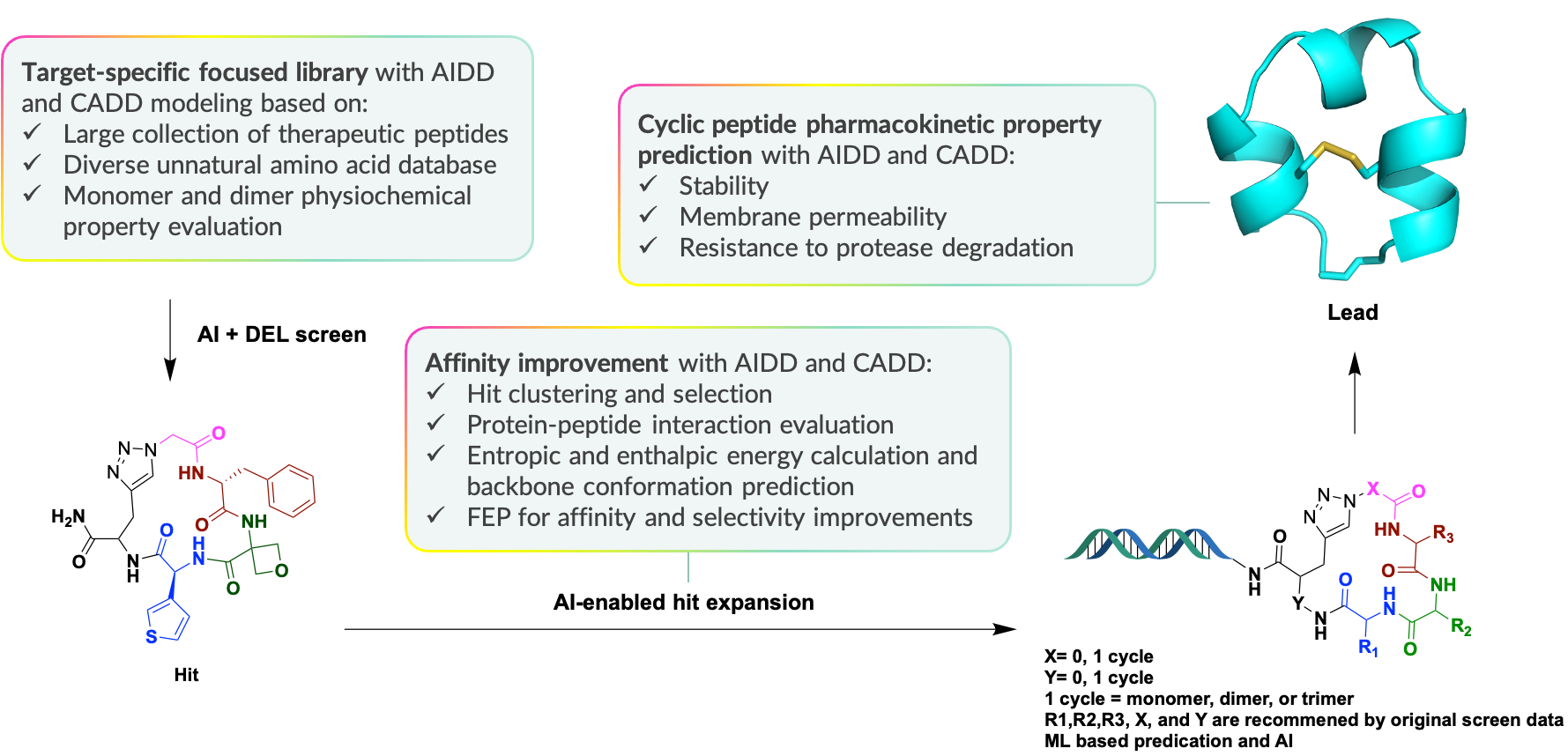
以AI为中心的DEL环肽筛选流程
抗体设计新范式:
人工智能和实验的多轮迭代
亲和力成熟是抗体设计的重要环节,传统的实验筛选方法面临周期长、效率低、数据难以供AI算法学习利用等弊端,而引入计算和实验迭代优化,可以大大缩短实验周期,并通过充分学习多轮数据,不断完善模型,最终获得不基于经验知识的通用模型。目前,干湿实验结合的抗体设计已经成为维亚抗体亲和力成熟的常规流程,并取得了显著的成果。在下面的例子中,维亚计算化学和人工智能平台首先通过物理模型和深度学习相结合的算法预测了抗体抗原复合物结构,并做了两者相互作用关键氨基酸残基分析,在此基础上完成了虚拟突变、亲和力预测及抗体可开发性预测,最终有20条序列入选做ELISA实验测试,其中7条保持了相当的亲和力,1条获得了4倍的活性增益。通过学习第一轮的实验数据,计算模型和实验联动又进行了第二轮10条序列的测试,成功找到1条序列,其活性是野生型的7倍。
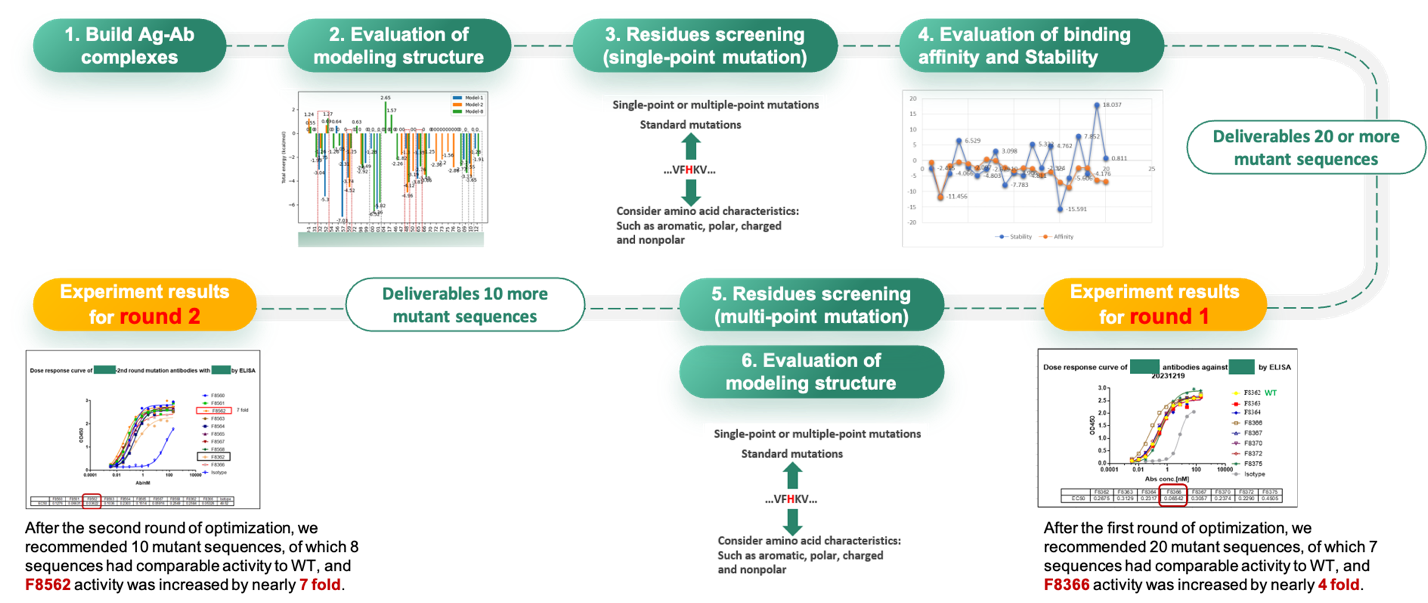
干湿实验结合的抗体亲和力成熟案例
De novo design/从头设计:
为药物设计带来前所未有的想象力
De novo design在计算化学领域由来已久,近几年来得到广泛关注和探究的生成式AI让这一思想在实践场景中能更充分的转化和落地,真正突破原有的化合物筛选和设计的限制,找到和靶标“完美匹配”的新颖分子。从头设计从根本上颠覆了原有的药物设计逻辑,跳过原本耗时数月的药物筛选流程一步到达苗头化合物发现的里程碑,再加上FEP对先导化合物优化阶段的效率加成,研发速率达到数量级上的提升。维亚生物计算平台不仅拥有对从头设计算法的把控,还基于对药物设计的深入理解在各个环节引入实验验证,特别是对生成分子的可合成性、类药性等指标做迭代验证,确保新方法在各个层面的可靠性。下图展示了基于蛋白口袋的从头设计分子(粉色)与已知晶体结构中小分子(绿色)的叠合图,这一设计兼具相互作用模式的相似性和分子的新颖性,为药物设计打开新思路,为创造新的分子提供无限可能。
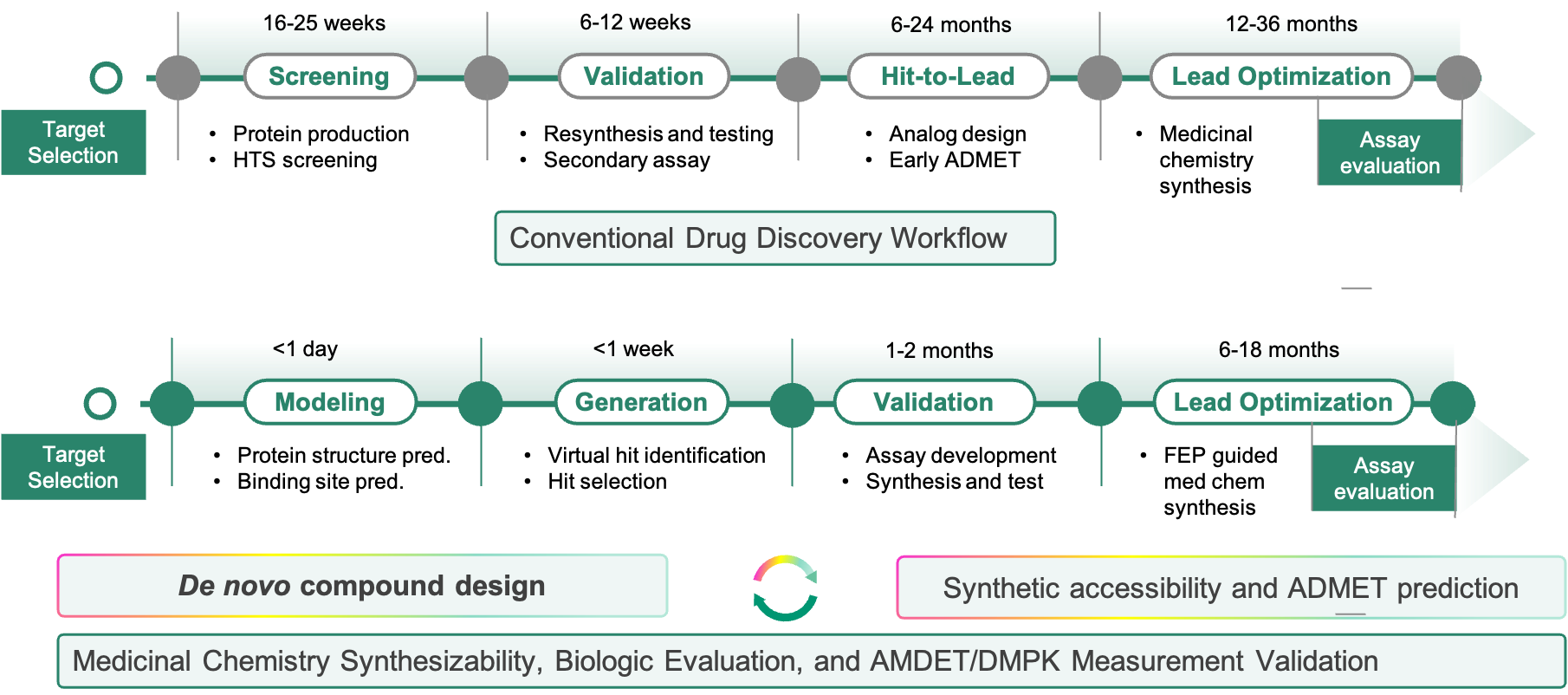
传统药物设计流程与从头设计流程对比
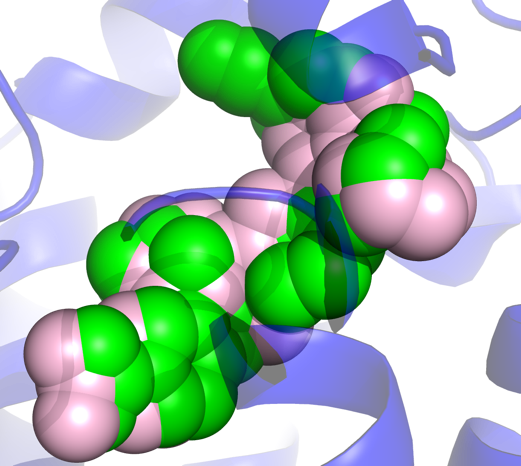
基于蛋白口袋的从头设计分子(粉色)与已知晶体结构中小分子(绿色)的叠合图
无论是小分子、靶向RNA小分子、多肽/环肽,抑或是抗体药物等,维亚在各个药物形态的计算驱动发现领域均取得了卓越的成就,充分展现了独特的竞争力。公司利用先进的物理化学模型和人工智能算法,结合上海超级计算集群的强大运算能力,已将AI算法广泛应用于各个药物研发阶段,还加入了全新的从头设计方法。维亚拥有一支以博士为主的复合型人才团队,他们紧跟药物设计最前沿进展,不仅掌握自研算法及开拓通用方法的能力,还在不断攻克针对多种药物形态的特殊技术难题。随着维亚高质量数据的不断积累和算法的持续优化,计算化学及人工智能在药物发现领域的应用前景将更加广阔。我们坚信,这一革命性技术将不断推动新药研发快算向前迈进,实现量变引起质变式的突破。
注:
AIDD:Artificial Intelligence Drug Discovery
CADD: Computer-aided Drug Discovery
SBDD: Structure-based Drug Discovery
Copyright © 维亚生物 All Rights Reserved. 沪ICP备19036061号